La estructura atómica: luz y física cuántica
Rutherford pudo imaginar la estructura básica de los átomos a través de interacciones entre materia. Sin embargo, ha sido la interacción entre luz y materia la que más pistas ha dado para comprender el átomo. Varias de estas pistas se conocían desde hace tiempo, pero sin embargo, eran resultados dispersos que hasta el descubrimiento del cuanto no se supo encajar.
Espectros de emisión y absorción
La espectroscopia es una técnica que se empieza a desarrollar en el siglo XVIII. La luz blanca está compuesta de distintos colores. Cuando se perciben todos juntos dan esa apariencia blanca. La espectroscopia descompone la luz en cada uno de los colores que la componen, muestra su espectro. Esta técnica se usó para identificar distintos elementos en gases a través de espectros de emisión y absorción.
Para obtener un espectro de emisión, se somete a alta temperatura un gas para que emita luz. En un espectro de absorción, un haz de luz blanca atraviesa un recipiente con el gas frío. En ambos casos, la luz final (emitida o que ha atravesado el gas) pasa por un prisma y se descompone en sus colores. En el caso de la emisión, el espectro descompuesto tan sólo lo forman unas líneas estrechas de un sólo color. En el espectro de absorción, el espectro está casi completo, mostrando todos los colores, excepto por unas líneas más oscuras, que se corresponden con la misma longitud de onda que las que se ven en la emisión del mismo elemento.

La descomposición del espectro de cada gas es única, de forma que es posible identificar elementos. J. von Fraunhofer (1787-1826) registró el espectro de la luz del Sol, en vez de la de un gas. Observó cómo existían líneas más oscuras que otras. Es decir, tomó un espectro de absorción, siendo el “gas” a analizar el propio Sol. Posteriormente, Gustav Kirchoff (1824-1887) demostró que algunas de esas líneas oscuras coincidían con líneas del sodio y otros elementos, mostrando así que el Sol está compuesto por átomos idénticos a los que hay en la Tierra.

Sin duda alguna, estos espectros de emisión y absorción estaban revelando aspectos interesantes de la estructura interna de los átomos. Sin embargo, el conocimiento disponible aquel entonces no era suficiente para poder establecer una relación clara y coherente.
Las líneas de Balmer
Los científicos se centraron en las líneas de emisión y absorción del hidrógeno, por ser el más simple. Johann J. Balmer (1825-1898), matemático suizo, consiguió establecer una relación matemática que reproducía las frecuencias de luz observadas, f.Lo interesante de la relación era que empleaba números enteros, ni y nf:
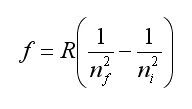
(donde R es la constante de Rydberg, R=3.2867e15 s-1)
A pesar de no entender lo que realmente significaba esta fórmula, Balmer consiguió describir las líneas visibles del hidrógeno, cuando nf=2, lo que se llama la Serie de Balmer, y predecir la existencia de otras series, que posterioremente se confirmaron: para nf=1 (serie de Lyman, líneas de ultravioleta), nf=3 (Serie de Parchen, líneas de infrarrojo) y nf=4 (serie de Brackett, en el infrarrojo)
La mecánica cuántica
El átomo de Rutherford suponía que los electrones giraban alejados de alrededor de su núcleo atómico, como si de un sistema solar se tratara. Este modelo preveía que los átomos emitieran radiación de forma continua, de acuerdo con el electromagnetismo de Maxwell, perdiendo energía y cayendo en espiral hasta su desintegración. El modelo era un buen avance, ya que definía la estructura del átomo, en concordancia con sus experimentos de bombardeo de partículas, pero no era correcto, y tampoco asomaba por ninguna parte ni un indicio que permitiera deducir la fórmula de Balmer.
1900 supone un gran descubrimiento: los cuantos de la radiación. Un cuerpo negro se define como aquel capaz de absorber toda la radiación incidente, sin reflejar absolutamente nada. Por otro lado, cualquier cuerpo, por estar a una temperatura determinada, emite radiación, y en particular, para un cuerpo negro esta emisión sólo dependía de su temperatura, y no de su forma o tipo de material. La radiación emitida por este cuerpo negro traía de cabeza a los científicos de la época, porque no eran capaces de explicarla.
Max Planck (1858-1947) encontró una relación matemática que explicaba la emisión, pero para lo cual necesitó una hipótesis por aquel entonces extraordinaria: en un espectro de radiación electromagnética como la del cuerpo negro, la energía no se repartía por igual, sino que a cada frecuencia le corresponde una cantidad fija (un cuanto), proporcional a su frecuencia, y por tanto, la energía total para una frecuencia determinada, es un múltiplo entero de esta energía mínima. Una frecuencia f, tiene una energía asociada hf (siendo h la constante de Planck, h=6.62e-34 J•s). Una fuente de luz que sólo emita en esa frecuencia, emitirá una energía total que es un múltiplo entero de hf: emitirá una energía 1•hf, ó 2•hf, ó 5•hf, etc, pero nunca emitirá 0.5•hf1, ó 2.45•hf1.
El átomo de hidrógeno de Bohr
Planck demostró que la energía de las ondas electromagnéticas estaban cuantizadas, eran múltiplos enteros de una energía mínima, un cuanto. Por otro lado, los espectros de emisión y absorción se podían describir por una fórmula que usaba números enteros. Fue el físico danés Niels Bohr (1885-1932) quien tomó estos datos aparentemente inconexos, para formular su modelo de átomo.
Bohr estaba de acuerdo con Rutherford en que los electrones debían girar alrededor del núcleo; pero tenían que existir ciertas condiciones para evitar su destrucción. En el átomo de Rutherford, no había restricción alguna, cualquier órbita era posible. La hipótesis de Bohr fue que sólo podían existir ciertas órbitas, aquellas tales que su momento angular fuera un múltiplo entero de la constante de Planck. Es decir, la distancia al núcleo a las que puede orbitar un electrón esta cuantizada con un valor mínimo. Además, añadió como un postulado que los electrones en estas órbitas no emitirían radiación.

Con este modelo de átomo, los electrones que cambian de órbita deben ganar o perder energía con un valor muy concreto, que dependía de la órbita inicial, y la órbita final. Al desarrollar estas ideas, Bohr llegó a la fórmula de Balmer. El átomo de Bohr describe los electrones del átomo de hidrógeno en torno a un único número entero n, que indica la órbita que ocupa. El significado de la fórmula de Balmer es que una transición desde un nivel inicial ni, hasta un nivel final nf absorbe radiación cuando un electrón sube a una órbita superior (nf mayor que ni), o emite radiación si la órbita final está por debajo de la inicial (nf menor que ni)
La frecuencia (o energía) de esta radiación tiene que ser la exacta para poder ser absorbida. Si es mayor o menor, no lo será. De igual forma, la energía emitida será siempre la misma. El conjunto de ondas electromagnéticas que se podían emitir o absorber es un conjunto discreto, tal y como se venía observando en espectros desde el Siglo XVIII.
El átomo de Bohr partía de la física clásica, al considerar los electrones como partículas que orbitan alrededor de un núcleo, y les aplicaba los primeros conceptos de física cuántica. Introducía así el concepto de número cuántico, el número n, que identifica la órbita en la que se halla el electrón. El modelo explicaba a la perfección el átomo de hidrógeno, es decir, un átomo con un solo electrón. Pero no era tan exacto para átomos de más electrones. Para ello se necesitó introducir más números cuánticos, que describían otro tipo de características de las órbitas que Bohr no contemplaba.
Por la (relativa) simplicidad de los cálculos teóricos, añado en entradas aparte para quien le pueda interesar:
- Cálculo del radio de las órbitas de Bohr
- Deducción de la fórmula de Balmer a partir del átomo de Bohr
Espectros de emisión y absorción
La espectroscopia es una técnica que se empieza a desarrollar en el siglo XVIII. La luz blanca está compuesta de distintos colores. Cuando se perciben todos juntos dan esa apariencia blanca. La espectroscopia descompone la luz en cada uno de los colores que la componen, muestra su espectro. Esta técnica se usó para identificar distintos elementos en gases a través de espectros de emisión y absorción.
Para obtener un espectro de emisión, se somete a alta temperatura un gas para que emita luz. En un espectro de absorción, un haz de luz blanca atraviesa un recipiente con el gas frío. En ambos casos, la luz final (emitida o que ha atravesado el gas) pasa por un prisma y se descompone en sus colores. En el caso de la emisión, el espectro descompuesto tan sólo lo forman unas líneas estrechas de un sólo color. En el espectro de absorción, el espectro está casi completo, mostrando todos los colores, excepto por unas líneas más oscuras, que se corresponden con la misma longitud de onda que las que se ven en la emisión del mismo elemento.

La descomposición del espectro de cada gas es única, de forma que es posible identificar elementos. J. von Fraunhofer (1787-1826) registró el espectro de la luz del Sol, en vez de la de un gas. Observó cómo existían líneas más oscuras que otras. Es decir, tomó un espectro de absorción, siendo el “gas” a analizar el propio Sol. Posteriormente, Gustav Kirchoff (1824-1887) demostró que algunas de esas líneas oscuras coincidían con líneas del sodio y otros elementos, mostrando así que el Sol está compuesto por átomos idénticos a los que hay en la Tierra.

Sin duda alguna, estos espectros de emisión y absorción estaban revelando aspectos interesantes de la estructura interna de los átomos. Sin embargo, el conocimiento disponible aquel entonces no era suficiente para poder establecer una relación clara y coherente.
Las líneas de Balmer
Los científicos se centraron en las líneas de emisión y absorción del hidrógeno, por ser el más simple. Johann J. Balmer (1825-1898), matemático suizo, consiguió establecer una relación matemática que reproducía las frecuencias de luz observadas, f.Lo interesante de la relación era que empleaba números enteros, ni y nf:
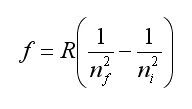
(donde R es la constante de Rydberg, R=3.2867e15 s-1)
A pesar de no entender lo que realmente significaba esta fórmula, Balmer consiguió describir las líneas visibles del hidrógeno, cuando nf=2, lo que se llama la Serie de Balmer, y predecir la existencia de otras series, que posterioremente se confirmaron: para nf=1 (serie de Lyman, líneas de ultravioleta), nf=3 (Serie de Parchen, líneas de infrarrojo) y nf=4 (serie de Brackett, en el infrarrojo)
La mecánica cuántica
El átomo de Rutherford suponía que los electrones giraban alejados de alrededor de su núcleo atómico, como si de un sistema solar se tratara. Este modelo preveía que los átomos emitieran radiación de forma continua, de acuerdo con el electromagnetismo de Maxwell, perdiendo energía y cayendo en espiral hasta su desintegración. El modelo era un buen avance, ya que definía la estructura del átomo, en concordancia con sus experimentos de bombardeo de partículas, pero no era correcto, y tampoco asomaba por ninguna parte ni un indicio que permitiera deducir la fórmula de Balmer.
1900 supone un gran descubrimiento: los cuantos de la radiación. Un cuerpo negro se define como aquel capaz de absorber toda la radiación incidente, sin reflejar absolutamente nada. Por otro lado, cualquier cuerpo, por estar a una temperatura determinada, emite radiación, y en particular, para un cuerpo negro esta emisión sólo dependía de su temperatura, y no de su forma o tipo de material. La radiación emitida por este cuerpo negro traía de cabeza a los científicos de la época, porque no eran capaces de explicarla.
Max Planck (1858-1947) encontró una relación matemática que explicaba la emisión, pero para lo cual necesitó una hipótesis por aquel entonces extraordinaria: en un espectro de radiación electromagnética como la del cuerpo negro, la energía no se repartía por igual, sino que a cada frecuencia le corresponde una cantidad fija (un cuanto), proporcional a su frecuencia, y por tanto, la energía total para una frecuencia determinada, es un múltiplo entero de esta energía mínima. Una frecuencia f, tiene una energía asociada hf (siendo h la constante de Planck, h=6.62e-34 J•s). Una fuente de luz que sólo emita en esa frecuencia, emitirá una energía total que es un múltiplo entero de hf: emitirá una energía 1•hf, ó 2•hf, ó 5•hf, etc, pero nunca emitirá 0.5•hf1, ó 2.45•hf1.
El átomo de hidrógeno de Bohr
Planck demostró que la energía de las ondas electromagnéticas estaban cuantizadas, eran múltiplos enteros de una energía mínima, un cuanto. Por otro lado, los espectros de emisión y absorción se podían describir por una fórmula que usaba números enteros. Fue el físico danés Niels Bohr (1885-1932) quien tomó estos datos aparentemente inconexos, para formular su modelo de átomo.
Bohr estaba de acuerdo con Rutherford en que los electrones debían girar alrededor del núcleo; pero tenían que existir ciertas condiciones para evitar su destrucción. En el átomo de Rutherford, no había restricción alguna, cualquier órbita era posible. La hipótesis de Bohr fue que sólo podían existir ciertas órbitas, aquellas tales que su momento angular fuera un múltiplo entero de la constante de Planck. Es decir, la distancia al núcleo a las que puede orbitar un electrón esta cuantizada con un valor mínimo. Además, añadió como un postulado que los electrones en estas órbitas no emitirían radiación.

Con este modelo de átomo, los electrones que cambian de órbita deben ganar o perder energía con un valor muy concreto, que dependía de la órbita inicial, y la órbita final. Al desarrollar estas ideas, Bohr llegó a la fórmula de Balmer. El átomo de Bohr describe los electrones del átomo de hidrógeno en torno a un único número entero n, que indica la órbita que ocupa. El significado de la fórmula de Balmer es que una transición desde un nivel inicial ni, hasta un nivel final nf absorbe radiación cuando un electrón sube a una órbita superior (nf mayor que ni), o emite radiación si la órbita final está por debajo de la inicial (nf menor que ni)
La frecuencia (o energía) de esta radiación tiene que ser la exacta para poder ser absorbida. Si es mayor o menor, no lo será. De igual forma, la energía emitida será siempre la misma. El conjunto de ondas electromagnéticas que se podían emitir o absorber es un conjunto discreto, tal y como se venía observando en espectros desde el Siglo XVIII.
El átomo de Bohr partía de la física clásica, al considerar los electrones como partículas que orbitan alrededor de un núcleo, y les aplicaba los primeros conceptos de física cuántica. Introducía así el concepto de número cuántico, el número n, que identifica la órbita en la que se halla el electrón. El modelo explicaba a la perfección el átomo de hidrógeno, es decir, un átomo con un solo electrón. Pero no era tan exacto para átomos de más electrones. Para ello se necesitó introducir más números cuánticos, que describían otro tipo de características de las órbitas que Bohr no contemplaba.
Anexos
Por la (relativa) simplicidad de los cálculos teóricos, añado en entradas aparte para quien le pueda interesar:
- Cálculo del radio de las órbitas de Bohr
- Deducción de la fórmula de Balmer a partir del átomo de Bohr



5 comentarios:
Hola:
Veo que no hay muchos comentarios en este blog. Eso sí, espero que tenga muchas visitas.
Este tipo de blogs no son importantes, son IM-PRES-CIN-DI-BLES. No es coba. El conocimiento de este tipo es fundamental no sólo para el desarrollo de la humanidad (como si esto fuera poco!) sino que son necesarios para erradicar (o al menos ayudar) la superstición, los engañabobos y magufos en general.
Nada, que simplemente quería demostrarte mi apoyo.
Saludos,
La verdad es que a mi de momento me va bien para repasar algunas cosas que se ven deprisando y corriendo en la asignatura de quantica en la uni y eso está muy bien. Espero que luego siga con dirac, schroedinger, y así poco a poco hasta los átomos hidrogenoides y tendremos la página perfecta para pegarle un repaso antes de los examenes.
deprisando y corriendo = deprisa y corriendo
Muchas gracias por los comentarios, que son de los primeros, más que nada porque este blog está "recien sacado del horno" :)
Anónimo, me alegro que te sirva para repasar, aunque la idea que tenía sobre cuántica era contar lo mínimo imprescindible para entender la estructura del átomo, para luego pasar a la estructura de un sólido, y ciertos efectos divertidos que ocurren gracias a al cuántica. No creo que me vaya a centrar en cosas como antipartículas de Dirac, por ejemplo. Pero bueno, también voy un poco improvisando :)
Gracias a ambos
Hola, buena tarde: me agrada esa forma de explicar en forma de hostoria, muy general, yo lo que buscaba era info. acerca de la teoria de bandas, pero esta info. encontrada en el sitio me fue muy útil para reafirmar lo que estoy aprendiendo. Agradezco el esfuerzo invertido en este blog , muy util.
Publicar un comentario