La estructura atómica: los modelos clásicos
El conocimiento de la estructura interna del átomo y cómo se organizan los electrones en èl, ha permitido entender posteriormente los enlaces para formar moléculas, cual es la estructura de un material sólido, y cómo los electrones se reagrupan dentro de éste, para darle, entre otras muchas, unas propiedades eléctricas y ópticas específicas.
El bizcocho de Thomson
John Dalton (1766-1844) fue el primer científico en empezar a definir qué es un átomo. A principios del Siglo XIX ya se sabía que la materia se podía dividir hasta llegar a un nivel elemental, un tipo de materia homogénea. La sal, por ejemplo, se podía separar en dos elementos bien diferenciados: sodio y cloro. Dalton, identificó estos materiales elementales como formados por átomos, partículas indivisibles básicas de la materia, de tal forma que átomos de distintos elementos eran distintos entre sí, mientras que átomos del mismo elemento eran idénticos. Sin embargo, las investigaciones de Dalton se centraron más en la química, y las proporciones en que se mezclaban los átomos para dar lugar a moléculas, y no entró en la estructura de átomo.
A pesar de que se conocía la existencia de cargas positivas y negativas desde tiempos de Coulomb (1736-1806), no fue hasta 1897 cuando se descubrió la existencia del electrón. El estudio de Sir J. J. Thomson (1856-1940) acerca de rayos catódicos le llevó a concluir que éstos se trataban de partículas, con una masa muy pequeña (9•10-31 Kg), y con una carga negativa, de 1.6•10-19 Culombios. Este descubrimiento le valió un Nobel en 1906.
Thomson, junto con Lord Kelvin (1824-1907), propusieron un modelo del átomo que consistía en una esfera uniforme de carga positiva, en la cual se hallaban incrustados los electrones, como las uvas pasas en un bizcocho. El modelo, por primera vez en la historia, venía a decir que un átomo no era indivisible, sino que tenía una estructura interna. Este modelo debía cumplir las leyes físicas conocidas en aquel momento. Las cargas negativas se deberían mover dentro del gran bizcocho siguiendo la mecánica de Newton, e igualmente, debería emitir radiación de acuerdo con la teoría de Maxwell del electromagnetismo, desarrollada apenas 20 años antes.
El mini-sistema solar de Rutherford
1907 supuso un gran avance en la concepción del átomo. Después de que Thomson identificara los rayos catódicos con los electrones, otro tipo de radiaciones también se pudieron identificar como partículas concretas. En particular, se comprobó que la radiación alfa, son átomos de helio cargados positivamente debido a que han perdido sus electrones. Ernst Rutherford (1871-1937) trabajaba con sus estudiantes en la dispersión de partículas alfa a través de láminas finas de oro. Las partículas cargadas se lanzaban a gran velocidad contra la lámina, y al atravesarla, eran desviadas debido a los choques entre la partícula alfa y los átomos de oro. Según el modelo de Thomson y Kelvin, la dispersión (o desviación) que debían sufrir las partículas debía ser pequeña.

En cambio, Rutherford detectaba dispersión a ángulos mayores que los predichos por el modelo. Aunque el hallazgo más interesante fue hecho por dos de sus estudiantes (Marsden y Geiger), quienes detectaron que la dispersión también se producía hacia atrás (había retrodispersión). Esto era simplemente asombroso, ya que era como disparar una pistola a una hoja de papel, ¡y que la bala rebotara!
Estos fenómenos llevaron a Rutherford a proponer un nuevo modelo de átomo, donde se concentraba una gran cantidad de masa con carga positiva en un punto muy pequeño del espacio, mientras que los electrones orbitaban alrededor de este núcleo, como si fuera un pequeño sistema solar. Las partículas alfa (núcleos de helio) en este modelo, atraviesan la lámina de oro, desviándose debido a la repulsión eléctrica con los núcleos atómicos cuando pasan cerca de uno, sin verse apenas afectadas por los electrones. Sólo en las raras veces en que se acercan demasiado, la repulsión hace retroceder a las partículas alfa.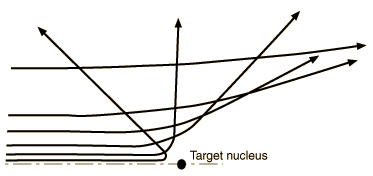
El modelo supone un gran cambio en la concepción de la materia, ya que revela que ésta es principalmente hueca. El tamaño del núcleo es del orden de 10-15 metros (entre 1 y 10 femtómetros o Fermis [fm]), y contiene prácticamente toda la masa, mientras que el radio del átomo contando con los electrones es de 10-10 metros (1 Angstrom [å]). Es decir, el núcleo representa tan sólo la cienmilésima parte (1/100.000) de un átomo. Por hacer una comparación más intuitiva, si un átomo tuviera un tamaño como la distancia de Madrid a Toledo (casi 100 km), su núcleo mediría entre 1 y 10 metros: tendría el tamaño de un coche.
La experiencia de Rutherford tiene además una importancia aplicada, ya que es la base para una técnica de análisis de materiales, la espectroscopía de retrodispersión de Rutherford (RBS, Rutherford Backscattering Spectroscopy), de la que hablaremos en algún momento.
Este modelo atómico, a pesar de ser simple y básicamente correcto para explicar la dispersión de partículas alfa, no estaba libre de problemas. En particular, según la teoría de Maxwell, el electrón al orbitar alrededor del núcleo debería emitir radiación de forma continua. De lo cual no había evidencia. Pero lo peor era que al emitir esa radiación, el electrón perdería energía, por lo que su órbita en realidad sería una espiral que finalmente caería al núcleo. Los átomos de Rutherford eran inestables.
La solución a estas fallas vino de mano de la mecánica cuántica, cuyo descubrimiento inicial por parte de Max Planck se había producido en 1900, en un tema en principio alejado de la estructura atómica, y de lo que hablaremos en la próxima entrada.



No hay comentarios:
Publicar un comentario